Casa dos Resumos
O conhecimento que temos atualmente sobre os átomos é resultado de observações e experimentos que vêm sendo realizados há mais de dois milênios. Desde aquela época, os cientistas vêm construindo modelos atômicos com base em fenômenos vistos na natureza, e não a partir de imagens reais de átomos.
Tudo começou com Tales de Mileto (624 a.C.-546 a.C.). Ele observou que, ao serem usadas, as bobinas de âmbar das tecelãs atraíam fiapos de tecido e fios de cabelo.
Passado algum tempo, surgiram os alquimistas - pesquisadores que, na busca pela fórmula da riqueza e da imortalidade, descobriram muitas substâncias, como o fósforo e o zinco.
Charles du Fay (1698-1739) observou que, quando duas varetas de vidro eram atritadas contra tecidos e depois colocadas próximas, elas se repeliam. Contudo, quando o experimento era feito com uma vareta de vidro e uma de âmbar, elas se atraíam.
Benjamin Franklin (1706-1790) renomeou a eletricidade vítrea para positiva e a eletricidade resinosa para negativa. Ele também imaginou que todos os corpos possuíam uma quantidade natural de eletricidade e que, quando um corpo tivesse excesso de carga elétrica, teria carga total positiva. Quando tivesse falta de carga elétrica, teria carga total negativa.
Além de John Dalton (1766-1844) descobrir o daltonismo, ele supôs que os elementos químicos se diferenciavam pelo peso de seus respectivos átomos. Dalton constatou que compostos químicos eram formados pela união de átomos diferentes em proporções específicas.
Joseph John Thomson (1856-1940) testou uma ampola de Crookes modificada e concluiu que as cargas elétricas atraídas pelo polo positivo estavam concentradas em pequenas partículas, chamadas por ele de elétrons. Thomson foi o primeiro físico a discordar da indivisibilidade do átomo.
Antoine Becquerel (1852-1908) descobriu a radioatividade, ou seja, a tendência de alguns átomos de emitirem partículas naturalmente.
Ernest Rutherford (1871-1937) realizou um experimento fundamental para a compreensão moderna do átomo. Ele colocou o material radioativo polônio em uma caixa de chumbo, que impedia que a radiação saísse. Fez um buraco na caixa, de onde começaram a sair partículas conhecidas como partículas alfa, que têm carga positiva. Rutherford colocou uma fina placa de ouro na frente da caixa e um material cintilante rodeando a lâmina.
Após algum tempo, ele observou que muitas partículas atravessaram a lâmina. Isso o fez concluir que elas eram menores que os átomos de ouro e que havia muito espaço vazio nos átomos. Porém, outras partículas desviaram-se do percurso retilíneo. Isso o fez concluir que os núcleos dos átomos de ouro eram positivos, pois as partículas alfa, positivas, passaram muito perto deles e sofreram repulsão. Algumas partículas foram rebatidas para trás, por colidirem frontalmente com os átomos de ouro.
Além disso, o físico notou que alguns átomos de mesmo número de prótons, em estado neutro, tinham massas diferentes. Ele supôs que deveria haver uma outra partícula no núcleo além dos prótons, batizada de nêutron. Rutherford ajudou a criar, portanto, o conceito de isótopo, ou seja, de átomos de mesmo número de prótons e números diferentes de nêutrons.
Niels Bohr (1885-1962) imaginou que os elétrons se distribuíam em 7 camadas que compunham a eletrosfera. As camadas foram chamadas de K, L, M, N, O, P e Q e cada uma delas podia acomodar até 2, 8, 18, 32, 32, 18 e 2 elétrons respectivamente.
Analisemos alguns dos eventos relatados do ponto de vista contemporâneo. O experimento de Tales de Mileto consistia na transferência de elétrons do tecido para o âmbar devido ao atrito, fazendo com que ele ficasse com mais elétrons que prótons e atraísse pequenos objetos. Esse tipo de eletrização acontece porque algumas substâncias têm mais facilidade de perder elétrons do que outras.
Quando Franklin dizia que um corpo estava com excesso de carga, o material estava com excesso de prótons devido à perda de elétrons. Quando o físico dizia que um corpo estava com falta de carga, o material estava com falta de prótons devido ao excesso de elétrons.
- Química: Representação Dos átomos, Isótopos, Isótonos E Isóbaros
Geralmente, os elementos químicos e seus respectivos átomos são representados por uma ou duas letras derivadas do seu nome em latim ou grego. O número atômico (número de prótons que o átomo daquele elemento tem) deve ser escrito à esquerda da...
- A Estrutura Do átomo
A estrutura do átomo O átomo tem como composição os elétrons, prótons e nêutrons. Os prótons tem carga positiva, os elétrons têm carga negativa e os nêutrons como o próprio nome diz não tem carga. Referente ao peso o elétron tem peso quase...
- Modelo Atômico
Modelo atômico O conceito de átomo começou antes de cristo quando Demócrito disse que toda matéria era construída por partículas minúsculas, individuais denominadas átomos. Os principais modelos: O modelo de John Dalton ? bola de bilhar-1808:...
- Quimica
Cátions e ânions são íons (átomos ou moléculas que perderam ou ganharam elétrons). Cátions têm carga positiva e ânions carga negativa. Por que isso? Simples: Alguns átomos, para se tornarem estáveis, liberam ou ganham elétrons, até que sua...
- Quimica
Modelos atômicos: A constituição da matéria é motivo de muita curiosidade entre os povos antigos. Filósofos buscam há tempos a constituição dos materiais. Resultado dessa curiosidade implicou na descoberta do fogo, o que o permitiu cozinhar os...
Casa dos Resumos
Química: a evolução do modelo atômico
O conhecimento que temos atualmente sobre os átomos é resultado de observações e experimentos que vêm sendo realizados há mais de dois milênios. Desde aquela época, os cientistas vêm construindo modelos atômicos com base em fenômenos vistos na natureza, e não a partir de imagens reais de átomos.
Tudo começou com Tales de Mileto (624 a.C.-546 a.C.). Ele observou que, ao serem usadas, as bobinas de âmbar das tecelãs atraíam fiapos de tecido e fios de cabelo.
 |
| Tales atritou um pedaço de âmbar contra um pedaço de tecido e confirmou o fenômeno observado. |
Charles du Fay (1698-1739) observou que, quando duas varetas de vidro eram atritadas contra tecidos e depois colocadas próximas, elas se repeliam. Contudo, quando o experimento era feito com uma vareta de vidro e uma de âmbar, elas se atraíam.
 |
| Isso levou o físico a desconfiar que havia dois tipos de eletricidade, batizados por ele de eletricidade vítrea e eletricidade resinosa. |
 |
| Em um dia tempestuoso, Franklin empinou uma pipa com uma chave amarrada no meio da linha e a extremidade onde ele segurava eletricamente isolada. A chuva molhou a linha, tornando-a condutora e, toda vez que surgia um raio, a chave soltava faíscas, levando o físico a comprovar que a energia passara pelo fio até chegar na chave. Esse experimento permitiu que Franklin inventasse o para-raios. |
 |
| De acordo com John Dalton, os átomos seriam minúsculas esferas indivisíveis. |
 |
| Para ele, o átomo seria uma esfera de carga positiva com elétrons espalhados em seu interior, como passas num pudim, de forma que a carga negativa e a positiva se anulassem, tornando o átomo eletricamente neutro. |
 |
| Becquerel constatou esse fenômeno ao deixar acidentalmente sais de urânio em cima de uma placa fotográfica, que escureceu. |
Após algum tempo, ele observou que muitas partículas atravessaram a lâmina. Isso o fez concluir que elas eram menores que os átomos de ouro e que havia muito espaço vazio nos átomos. Porém, outras partículas desviaram-se do percurso retilíneo. Isso o fez concluir que os núcleos dos átomos de ouro eram positivos, pois as partículas alfa, positivas, passaram muito perto deles e sofreram repulsão. Algumas partículas foram rebatidas para trás, por colidirem frontalmente com os átomos de ouro.
 |
| Para Rutherford, o átomo possuiria um núcleo onde se concentrariam cargas positivas, chamadas por ele de prótons, e, ao redor desse núcleo, circulariam os elétrons. |
Niels Bohr (1885-1962) imaginou que os elétrons se distribuíam em 7 camadas que compunham a eletrosfera. As camadas foram chamadas de K, L, M, N, O, P e Q e cada uma delas podia acomodar até 2, 8, 18, 32, 32, 18 e 2 elétrons respectivamente.
 |
| Bohr construiu o Modelo de Rutherford-Bohr. |
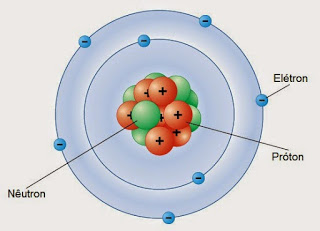 |
| Em seu modelo, os prótons (partículas positivas) e os nêutrons (partículas sem carga elétrica) teriam massas similares, enquanto os elétrons (partículas negativas) teriam massas cerca de 1840 vezes menores que as das partículas nucleares. |
Quando Franklin dizia que um corpo estava com excesso de carga, o material estava com excesso de prótons devido à perda de elétrons. Quando o físico dizia que um corpo estava com falta de carga, o material estava com falta de prótons devido ao excesso de elétrons.
Para John Dalton, elementos químicos se diferenciavam pelo peso de seus respectivos átomos. Na verdade, elementos químicos se diferenciam pela quantidade de prótons de seus respectivos átomos. Em outras palavras, se a alteração dos prótons fosse possível, poderíamos criar qualquer substância. Possível é, só não é viável, já que seria necessário alterar os átomos um a um, inúmeras vezes.
Por fim, muitos cientistas erraram ao dizer que o átomo era indivisível, pois hoje se sabe que seu núcleo é formado por prótons e nêutrons que, por sua vez, são formados por partículas ainda menores - os quarks.
Algumas partículas dos núcleos dos átomos são positivas e, por isso, deveriam se repelir. Acontece que há uma atração entre elas maior que a repulsão eletromagnética, chamada de força forte.
 |
| O Gerador de Van der Graaff é uma máquina bastante didática e divertida que faz os fios de cabelo da pessoa que a toca ficarem arrepiados. Isso acontece porque o gerador atrai elétrons do corpo da pessoa, fazendo com que ela fique com carga total positiva. Logicamente, seus fios de cabelo também ficam positivos e repelem uns aos outros. |
loading...
- Química: Representação Dos átomos, Isótopos, Isótonos E Isóbaros
Geralmente, os elementos químicos e seus respectivos átomos são representados por uma ou duas letras derivadas do seu nome em latim ou grego. O número atômico (número de prótons que o átomo daquele elemento tem) deve ser escrito à esquerda da...
- A Estrutura Do átomo
A estrutura do átomo O átomo tem como composição os elétrons, prótons e nêutrons. Os prótons tem carga positiva, os elétrons têm carga negativa e os nêutrons como o próprio nome diz não tem carga. Referente ao peso o elétron tem peso quase...
- Modelo Atômico
Modelo atômico O conceito de átomo começou antes de cristo quando Demócrito disse que toda matéria era construída por partículas minúsculas, individuais denominadas átomos. Os principais modelos: O modelo de John Dalton ? bola de bilhar-1808:...
- Quimica
Cátions e ânions são íons (átomos ou moléculas que perderam ou ganharam elétrons). Cátions têm carga positiva e ânions carga negativa. Por que isso? Simples: Alguns átomos, para se tornarem estáveis, liberam ou ganham elétrons, até que sua...
- Quimica
Modelos atômicos: A constituição da matéria é motivo de muita curiosidade entre os povos antigos. Filósofos buscam há tempos a constituição dos materiais. Resultado dessa curiosidade implicou na descoberta do fogo, o que o permitiu cozinhar os...
