Casa dos Resumos

- Óxidos
Óxidos Esses elementos são caracterizados por se tratarem de compostos binários, ou seja, formados por dois elementos ? como é o caso do seguinte exemplo: FeO + Fe2O3 = Fe3O4 ? sendo um dos quais o oxigênio, e algum outro que esteja presente...
- Calor Específico E Capacidade Térmica
O calor específico consiste na quantidade de calor que é necessário fornecer à unidade de massa de uma substância para elevar a sua temperatura de um grau e expressa-se em calorias por grama e por grau. Para o caso da água, o calor específico foi convencionado ser de 1 cal/kg....
- Calor Sensível E Calor Latente
Calor Sensível Sabemos que calor é energia térmica em trânsito que flui entre os corpos em razão da diferença de temperatura entre eles. Dessa forma, imagine uma barra de ferro que receba ou perca certa quantidade de calor Q. Esse calor que...
- Quimica
Cátions e ânions são íons (átomos ou moléculas que perderam ou ganharam elétrons). Cátions têm carga positiva e ânions carga negativa. Por que isso? Simples: Alguns átomos, para se tornarem estáveis, liberam ou ganham elétrons, até que sua...
- Biologia,,
FOTOSSINTESE *Dividida em duas fases, uma clara e outra escura. Fase Clara ( FOTOQUIMICA) *Ocorre com a presença de LUZ +CLOROFILA *O sol libera a luz, transformada em energia a partir das moléculas de clorofila. *local: tilacoide * reagente : H2O...
Casa dos Resumos
A água: propriedades e importância para os organismos
ÁGUA: PROPRIEDADES E IMPORTÂNCIA PARA OS ORGANISMOS -
Maximiliano Mendes - 2013
Sem água a vida como conhecemos não poderia existir. Essa molécula é tão importante que só um dia de falta d?água na vizinhança é capaz de tirar muita gente do sério: a nossa hidratação e a nossa higiene podem ficar comprometidas e pior ainda é saber que há conflitos no oriente médio e na Ásia central pelo controle de fontes de água. E por que a água é tão essencial? Por conta de suas propriedades físico-químicas. Vejamos mais sobre ela:
Cerca de 70 % da superfície do planeta é coberta por água e acredita-se que a vida tenha surgido no ambiente aquático. Isso contribui para que ela seja uma molécula tão essencial para os organismos até hoje. A maior parte da massa de um ser vivo é constituída de água, de 70 ? 80 % (o percentual pode variar de acordo com o tipo de tecido, sendo de aproximadamente 20 % no tecido ósseo e por volta de 85 % para o tecido nervoso cerebral). Além disso, as reações metabólicas ocorrem em meio aquoso, pois a água é um solvente (comentaremos mais sobre isso adiante).
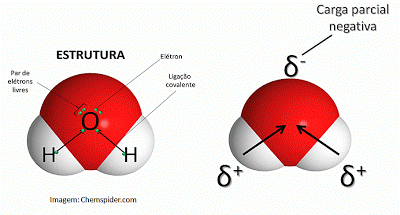
A fórmula molecular da água é H2O e sua estrutura pode ser vista na figura abaixo:

O átomo de oxigênio é mais eletronegativo que o de hidrogênio, então, na molécula de água ele atrai os elétrons compartilhados nas ligações covalentes com maior intensidade, de forma que fica com uma densidade eletrônica maior e carga parcial negativa (?-), visto que os elétrons têm carga negativa. Ao mesmo tempo, por terem seus elétrons atraídos pelo oxigênio, os hidrogênios ficam com carga parcial positiva (?+) (é como se a tendência fosse eles perderem cargas negativas). Por conta disso, a molécula de água é polar: têm um polo (região) negativo e um polo positivo, como se pode ver na figura acima.
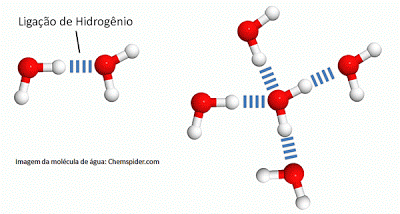
Em decorrência de sua polaridade e estrutura, a molécula de água pode formar ligações de hidrogênio entre si e com outras moléculas polares. A ligação de hidrogênio é uma interação na qual um átomo bastante eletronegativo, com carga parcial negativa, atrai para si um hidrogênio com carga parcial positiva de uma molécula vizinha. Cada molécula de água pode formar até quatro ligações de hidrogênio: duas para cada átomo de hidrogênio (?+) e duas para cada par de elétrons livres do oxigênio (?-). No Estado sólido as moléculas de água estão dispostas de modo que formam quatro ligações de hidrogênio umas com as outras e disso decorre que ficam mais afastadas. Assim, a água no estado sólido é menos densa que a água no estado líquido, por isso o gelo boia na água.

Graças às ligações de hidrogênio, as moléculas de água tendem a se manter unidas, coesas, e podem formar uma ?película? na superfície em contato com o ar, por isso, as gotas d?água têm formato arredondado e alguns insetos conseguem andar na superfície da água sem afundar, pois a força peso que exercem sobre a superfície da água não é o bastante para romper essa película (note que esses insetos não estão boiando sobre a superfície da água!).

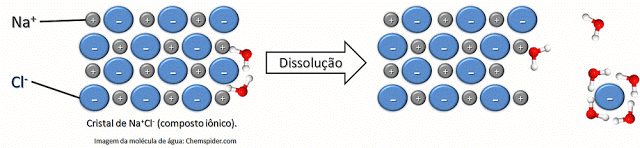
Ainda devido às suas propriedades físico-químicas, a água pode atuar como solvente. Um solvente é uma substância que atua separando agregados ou cristais de outras substâncias. Por exemplo, a água pode dissolver um cristal de sal de cozinha (NaCl) ao interagir e separar os íons componentes, o Na+, que interage com o oxigênio de carga parcial negativa, e o Cl-, que interage com os hidrogênios de carga parcial positiva.

As substâncias podem ser classificadas em dois tipos, de acordo com sua afinidade pela molécula de água:
- Hidrofílicas: são moléculas polares, têm afinidade pela água e podem ser dissolvidas em água. Ex: os glicídios.
- Hidrofóficas: são moléculas apolares, não têm afinidade pela água e não se dissolvem na água. Os principais exemplos são os lipídios.
A água também está envolvida em diversas reações químicas que ocorrem dentro das células, sendo basicamente:
- Desidratação: a água atua como produto da reação. Exemplo: A + B --> C + H2O
- Hidrólise: a água atua como reagente da reação. Exemplo: D + H2O --> E + F
Outra função importante da água, que também se deve às suas propriedades físico-químicas, é a de moderadora da temperatura do organismo: ela previne variações bruscas de temperatura. Os motivos pelos quais ela é capaz de atuar dessa forma são:
- Calor específico elevado: É difícil esquentar ou esfriar a água.
- Calor latente de vaporização elevado: Ela ?rouba? bastante calor quando evapora, pois para isso é preciso romper as ligações de hidrogênio. Graças a isso pode resfriar o organismo e evitar o superaquecimento.
- Calor latente de fusão elevado: A água tem de liberar muito calor para congelar, ou seja, não congela facilmente.
Atenção para as definições:
- Calor específico: quantidade de calor que um grama de uma substância deve absorver para elevar sua temperatura em 1° C, sem que haja mudança de estado físico.
- Calor latente de vaporização: quantidade de calor absorvida durante a vaporização de uma substância em seu ponto de ebulição.
- Calor latente de fusão: quantidade de calor necessária para transformar um grama de uma substância no estado sólido para o estado liquido, na temperatura de fusão.
Referências:
Amabis & Martho. Biologia das Células. Moderna. 2010.
Campbell, Reece et al. Biologia. 8ª ed. Artmed. 2010.
http://en.wikipedia.org/wiki/Animal_locomotion_on_the_water_surface
http://en.wikipedia.org/wiki/Water_conflict
http://apod.nasa.gov/apod/ap120515.html
Gostou do material? Achou útil? Quer me ajudar? Clique nos anúncios.
Gostou do material? Achou útil? Quer me ajudar? Clique nos anúncios.
loading...
- Óxidos
Óxidos Esses elementos são caracterizados por se tratarem de compostos binários, ou seja, formados por dois elementos ? como é o caso do seguinte exemplo: FeO + Fe2O3 = Fe3O4 ? sendo um dos quais o oxigênio, e algum outro que esteja presente...
- Calor Específico E Capacidade Térmica
O calor específico consiste na quantidade de calor que é necessário fornecer à unidade de massa de uma substância para elevar a sua temperatura de um grau e expressa-se em calorias por grama e por grau. Para o caso da água, o calor específico foi convencionado ser de 1 cal/kg....
- Calor Sensível E Calor Latente
Calor Sensível Sabemos que calor é energia térmica em trânsito que flui entre os corpos em razão da diferença de temperatura entre eles. Dessa forma, imagine uma barra de ferro que receba ou perca certa quantidade de calor Q. Esse calor que...
- Quimica
Cátions e ânions são íons (átomos ou moléculas que perderam ou ganharam elétrons). Cátions têm carga positiva e ânions carga negativa. Por que isso? Simples: Alguns átomos, para se tornarem estáveis, liberam ou ganham elétrons, até que sua...
- Biologia,,
FOTOSSINTESE *Dividida em duas fases, uma clara e outra escura. Fase Clara ( FOTOQUIMICA) *Ocorre com a presença de LUZ +CLOROFILA *O sol libera a luz, transformada em energia a partir das moléculas de clorofila. *local: tilacoide * reagente : H2O...
