Casa dos Resumos
Teoria Atômica
- Demócrito: Ele era discípulo de Leucipo, Demócrito dizia que se dividíssemos uma matéria (independente de qual fosse) acharíamos o átomo, este é uma porção indivisível da matéria.
- Dalton: Também dizia que o átomo era indivisível, mas ele dizia que cada átomo tinha uma propriedade que caracterizava. Teoria de Dalton:
- Toda matéria é constituída de átomos
- Todos os átomos são as menores partículas da matéria, e átomos de diferentes elementos químicos possuem propriedades diferentes (e massa também). Os átomos são indivisíveis.
- Os átomos de mesmo elemento tem propriedades iguais e também a massa.
Seu modelo ficou conhecido como bola de bilhar.
- Thomson: Ele associou a eletricidade com os átomos(em 1874), e em 1891 ele deu o nome de elétron para a unidade de carga elétrica. Ele se diferenciava do Dalton pois já se podia achar algo do átomo, o que derrubava a ideia de que o átomo é indivisível. Com base nisso, ele criou um átomo como uma esfera uniforme, de massa uniforme de carga positiva. incrustada de elétrons. Seu modelo foi apelidado de pudim de passas.
- Rutherford: A fim de verificar se os átomos são maciços, Rutherford propôs um modelo atômico baseando-se em experimentos com radioatividade. Ele concluiu que
1. Na eletrosfera dos átomos de ouro existem espaços e algumas partículas atravessavam a lâmina passando por tais espaços.
2. As partículas alfa se desviavam porque colidiam com o núcleo dos átomos de ouro.
3. O núcleo é positivo, por isso repele as partículas alfa de carga positiva.4. O núcleo é pequeno em relação ao átomo. Um átomo é composto por um pequeno núcleo carregado positivamente e rodeado por uma grande eletrosfera, que é uma região envolta do núcleo que contém elétrons. No núcleo está concentrada a carga positiva e a maior parte da massa do átomo.
- Bohr: O modelo de Bohr representa os níveis de energia. Cada elétron possui a sua energia. É comparado às orbitas dos planetas do Sistema Solar, onde cada elétron possui a sua própria órbita e com quantidades de energia já determinadas. Bohr organizou os elétrons em camadas ou níveis de energia.
Cada camada possui um nome e deve ter um número máximo de elétron.
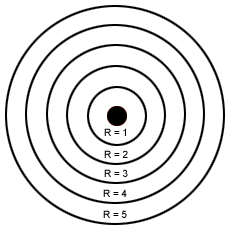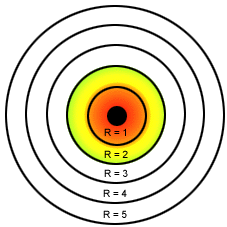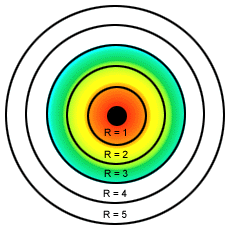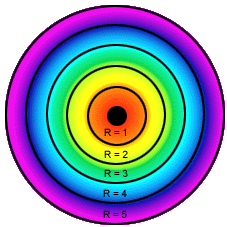 Existem sete camadas ou níveis de energia ao redor do núcleo: K, L, M, N, O, P, Q.
Existem sete camadas ou níveis de energia ao redor do núcleo: K, L, M, N, O, P, Q.
- Química: Representação Dos átomos, Isótopos, Isótonos E Isóbaros
Geralmente, os elementos químicos e seus respectivos átomos são representados por uma ou duas letras derivadas do seu nome em latim ou grego. O número atômico (número de prótons que o átomo daquele elemento tem) deve ser escrito à esquerda da...
- Química: A Evolução Do Modelo Atômico
O conhecimento que temos atualmente sobre os átomos é resultado de observações e experimentos que vêm sendo realizados há mais de dois milênios. Desde aquela época, os cientistas vêm construindo modelos atômicos com base em fenômenos...
- A Estrutura Do átomo
A estrutura do átomo O átomo tem como composição os elétrons, prótons e nêutrons. Os prótons tem carga positiva, os elétrons têm carga negativa e os nêutrons como o próprio nome diz não tem carga. Referente ao peso o elétron tem peso quase...
- Quimica
Cátions e ânions são íons (átomos ou moléculas que perderam ou ganharam elétrons). Cátions têm carga positiva e ânions carga negativa. Por que isso? Simples: Alguns átomos, para se tornarem estáveis, liberam ou ganham elétrons, até que sua...
- Quimica
Modelos atômicos: A constituição da matéria é motivo de muita curiosidade entre os povos antigos. Filósofos buscam há tempos a constituição dos materiais. Resultado dessa curiosidade implicou na descoberta do fogo, o que o permitiu cozinhar os...
Casa dos Resumos
Modelo atômico
Teoria Atômica
- Demócrito: Ele era discípulo de Leucipo, Demócrito dizia que se dividíssemos uma matéria (independente de qual fosse) acharíamos o átomo, este é uma porção indivisível da matéria.
- Dalton: Também dizia que o átomo era indivisível, mas ele dizia que cada átomo tinha uma propriedade que caracterizava. Teoria de Dalton:
- Toda matéria é constituída de átomos
- Todos os átomos são as menores partículas da matéria, e átomos de diferentes elementos químicos possuem propriedades diferentes (e massa também). Os átomos são indivisíveis.
- Os átomos de mesmo elemento tem propriedades iguais e também a massa.
Seu modelo ficou conhecido como bola de bilhar.
- Thomson: Ele associou a eletricidade com os átomos(em 1874), e em 1891 ele deu o nome de elétron para a unidade de carga elétrica. Ele se diferenciava do Dalton pois já se podia achar algo do átomo, o que derrubava a ideia de que o átomo é indivisível. Com base nisso, ele criou um átomo como uma esfera uniforme, de massa uniforme de carga positiva. incrustada de elétrons. Seu modelo foi apelidado de pudim de passas.
- Rutherford: A fim de verificar se os átomos são maciços, Rutherford propôs um modelo atômico baseando-se em experimentos com radioatividade. Ele concluiu que
1. Na eletrosfera dos átomos de ouro existem espaços e algumas partículas atravessavam a lâmina passando por tais espaços.
2. As partículas alfa se desviavam porque colidiam com o núcleo dos átomos de ouro.
3. O núcleo é positivo, por isso repele as partículas alfa de carga positiva.4. O núcleo é pequeno em relação ao átomo. Um átomo é composto por um pequeno núcleo carregado positivamente e rodeado por uma grande eletrosfera, que é uma região envolta do núcleo que contém elétrons. No núcleo está concentrada a carga positiva e a maior parte da massa do átomo.
- Bohr: O modelo de Bohr representa os níveis de energia. Cada elétron possui a sua energia. É comparado às orbitas dos planetas do Sistema Solar, onde cada elétron possui a sua própria órbita e com quantidades de energia já determinadas. Bohr organizou os elétrons em camadas ou níveis de energia.
Cada camada possui um nome e deve ter um número máximo de elétron.

loading...
- Química: Representação Dos átomos, Isótopos, Isótonos E Isóbaros
Geralmente, os elementos químicos e seus respectivos átomos são representados por uma ou duas letras derivadas do seu nome em latim ou grego. O número atômico (número de prótons que o átomo daquele elemento tem) deve ser escrito à esquerda da...
- Química: A Evolução Do Modelo Atômico
O conhecimento que temos atualmente sobre os átomos é resultado de observações e experimentos que vêm sendo realizados há mais de dois milênios. Desde aquela época, os cientistas vêm construindo modelos atômicos com base em fenômenos...
- A Estrutura Do átomo
A estrutura do átomo O átomo tem como composição os elétrons, prótons e nêutrons. Os prótons tem carga positiva, os elétrons têm carga negativa e os nêutrons como o próprio nome diz não tem carga. Referente ao peso o elétron tem peso quase...
- Quimica
Cátions e ânions são íons (átomos ou moléculas que perderam ou ganharam elétrons). Cátions têm carga positiva e ânions carga negativa. Por que isso? Simples: Alguns átomos, para se tornarem estáveis, liberam ou ganham elétrons, até que sua...
- Quimica
Modelos atômicos: A constituição da matéria é motivo de muita curiosidade entre os povos antigos. Filósofos buscam há tempos a constituição dos materiais. Resultado dessa curiosidade implicou na descoberta do fogo, o que o permitiu cozinhar os...
