Casa dos Resumos
- Química: Representação Dos átomos, Isótopos, Isótonos E Isóbaros
Geralmente, os elementos químicos e seus respectivos átomos são representados por uma ou duas letras derivadas do seu nome em latim ou grego. O número atômico (número de prótons que o átomo daquele elemento tem) deve ser escrito à esquerda da...
- Ligação Covalente
LIGAÇÃO COVALENTEA ligação covalente, geralmente é feita entre os não-metais e não metais, hidrogênio e não-metais e hidrogênio com hidrogênio. Esta ligação é caracterizada pelo compartilhamento de elétrons. O hidrogênio possui um elétron...
- A Estrutura Do átomo
A estrutura do átomo O átomo tem como composição os elétrons, prótons e nêutrons. Os prótons tem carga positiva, os elétrons têm carga negativa e os nêutrons como o próprio nome diz não tem carga. Referente ao peso o elétron tem peso quase...
- Modelo Atômico
Modelo atômico O conceito de átomo começou antes de cristo quando Demócrito disse que toda matéria era construída por partículas minúsculas, individuais denominadas átomos. Os principais modelos: O modelo de John Dalton ? bola de bilhar-1808:...
- Quimica
Cátions e ânions são íons (átomos ou moléculas que perderam ou ganharam elétrons). Cátions têm carga positiva e ânions carga negativa. Por que isso? Simples: Alguns átomos, para se tornarem estáveis, liberam ou ganham elétrons, até que sua...
Casa dos Resumos
Química I
DISTRIBUIÇÃO ELETRÔNICA
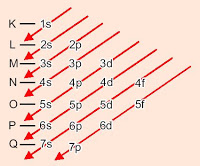
LIGAÇÕES QUIMICAS
*Os elementos querem imitar os gases nobres, ou seja, ter 8 elétrons na última camada (estabilidade)
* os outros elementos para adquirir estabilidade doam ou compartilham elétrons, fazendo ligações químicas
TEORIA DO OCTETO
? Um átomo adquire estabilidade quando possuir oito elétrons na última camada ( ou 2 elétrons quando essa camada for K)
? Obs: valência é o número de elétrons que um átomo precisa ganhar, perder ou compartilhar para alcançar estabilidade.
LIGAÇÃO IÔNICA
Ocorre entre:
METAL+AMETAL, METAL+HIDRÕGENIO
*transferência de elétrons.
METAL -----------------------------? AMETAL
*perde ou doa elétrons ganha elétrons, ÍON NEGATIVO, ÂNION
ÍON POSITIVO, CÁTION
*METAIS
-elementos eletropositivos
-ceder, doar, perder elétrons, CÁTION
*AMETAIS
-elementos eletronegativos
-ganha, recebe elétrons, ÂNION
OBSERVAÇÕES:
- O número de elétrons cedidos é igual ao total de cargas elétricas apresentadas pelo cátion.
-O número de cargas recebidas pelo átomo é igual ao total de cargas elétricas representadas pelo ânion.
LIGAÇÃO METÁLICA
*metal+metal
*metais são eletropositivos, tendência de doar, ceder, perder elétrons.
*NUVEM ELETRÔNICA
-No estado sólido, os átomos dos metais se agrupam de forma geometricamente ordenada, dando origem ao retículo cristalino.
-Alguns átomos do metal perdem ou soltam elétrons de suas últimas camadas; esses elétrons ficam passeando entre os átomos dos metais e funcionam como uma ?cola? que os mantém unidos.
--> elétrons livres, cátions
-quando vários átomos de metal são unidos, cada um deles libera seus elétrons de valência (elétrons da última camada), os quais constituirão o mar de elétrons, que numa ação conjunta com os núcleos positivos, cria forças de ligação que mantém os átomos ligados.
PROPRIEDADES DOS METAIS
-brilho, condutividade térmica e elétrica, alto ponto de fusão e ebulição, maleabilidade, ductibilidade (formar fio).
LIGAÇÃO COVALENTE
AMETAL+AMETAL
HIDROGÊNIO+HIDROGÊNIO,
AMETAL+HIDROGÊNIO.
Apolar: mesmo elemento
Polar: elementos diferentes
*compartilham elétrons
NÚMERO DE OXIDAÇÃO (NOX)? capacidade de ligação.
REGRAS PRÁTICAS:
metal alcalino: +1
Metal alcalino terroso: +2
Al: +3
O: -2
H: +1
REAÇÃO DE OXIRREDUÇÃO OU REDOX
Transferência de elétrons de um reagente para o outro.
OXIDAÇÃO: Perda de elétron, aumento do nox.Agente redutor
REDUÇÃO: Ganho de elétron, diminuição do nox.Agente Oxidante
Exemplo:
SO2 + H2O H2SO3
*O balanceamento se dá com o igual número de elétrons cedidos e recebidos.
Propriedades Periódicas
*RAIO ATÔMICO ? distância do núcleo á camada de valência do átomo. Aumentando o numero de camadas, aumentamos o raio atômico.
*ELETROPOSITIVIDADE ? tendência de um átomo em ceder, doar, perder elétrons. Quanto menor o raio atômico maior a eletropositividade.
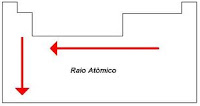
*ELETRONEGATIVIDADE = ELETROAFINIDADE - tendência de atrair, receber elétrons. Quanto menor o raio atômico mais a eletronegatividade. O flúor é o elemento mais eletronegativo.
*ENERGIA OU POTENCIAL DE IONIZAÇÃO ? energia necessária para remover um elétron de uma substancia no estado gasoso. A cada elétron removido, a energia de ionização aumenta.
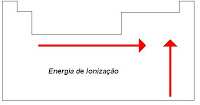

LIGAÇÕES QUIMICAS
*Os elementos querem imitar os gases nobres, ou seja, ter 8 elétrons na última camada (estabilidade)
* os outros elementos para adquirir estabilidade doam ou compartilham elétrons, fazendo ligações químicas
TEORIA DO OCTETO
? Um átomo adquire estabilidade quando possuir oito elétrons na última camada ( ou 2 elétrons quando essa camada for K)
? Obs: valência é o número de elétrons que um átomo precisa ganhar, perder ou compartilhar para alcançar estabilidade.
LIGAÇÃO IÔNICA
Ocorre entre:
METAL+AMETAL, METAL+HIDRÕGENIO
*transferência de elétrons.
METAL -----------------------------? AMETAL
*perde ou doa elétrons ganha elétrons, ÍON NEGATIVO, ÂNION
ÍON POSITIVO, CÁTION
*METAIS
-elementos eletropositivos
-ceder, doar, perder elétrons, CÁTION
*AMETAIS
-elementos eletronegativos
-ganha, recebe elétrons, ÂNION
OBSERVAÇÕES:
- O número de elétrons cedidos é igual ao total de cargas elétricas apresentadas pelo cátion.
-O número de cargas recebidas pelo átomo é igual ao total de cargas elétricas representadas pelo ânion.
LIGAÇÃO METÁLICA
*metal+metal
*metais são eletropositivos, tendência de doar, ceder, perder elétrons.
*NUVEM ELETRÔNICA
-No estado sólido, os átomos dos metais se agrupam de forma geometricamente ordenada, dando origem ao retículo cristalino.
-Alguns átomos do metal perdem ou soltam elétrons de suas últimas camadas; esses elétrons ficam passeando entre os átomos dos metais e funcionam como uma ?cola? que os mantém unidos.
--> elétrons livres, cátions
-quando vários átomos de metal são unidos, cada um deles libera seus elétrons de valência (elétrons da última camada), os quais constituirão o mar de elétrons, que numa ação conjunta com os núcleos positivos, cria forças de ligação que mantém os átomos ligados.
PROPRIEDADES DOS METAIS
-brilho, condutividade térmica e elétrica, alto ponto de fusão e ebulição, maleabilidade, ductibilidade (formar fio).
LIGAÇÃO COVALENTE
AMETAL+AMETAL
HIDROGÊNIO+HIDROGÊNIO,
AMETAL+HIDROGÊNIO.
Apolar: mesmo elemento
Polar: elementos diferentes
*compartilham elétrons
NÚMERO DE OXIDAÇÃO (NOX)? capacidade de ligação.
REGRAS PRÁTICAS:
metal alcalino: +1
Metal alcalino terroso: +2
Al: +3
O: -2
H: +1
REAÇÃO DE OXIRREDUÇÃO OU REDOX
Transferência de elétrons de um reagente para o outro.
OXIDAÇÃO: Perda de elétron, aumento do nox.Agente redutor
REDUÇÃO: Ganho de elétron, diminuição do nox.Agente Oxidante
Exemplo:
SO2 + H2O H2SO3
*O balanceamento se dá com o igual número de elétrons cedidos e recebidos.
Propriedades Periódicas
*RAIO ATÔMICO ? distância do núcleo á camada de valência do átomo. Aumentando o numero de camadas, aumentamos o raio atômico.
*ELETROPOSITIVIDADE ? tendência de um átomo em ceder, doar, perder elétrons. Quanto menor o raio atômico maior a eletropositividade.

*ELETRONEGATIVIDADE = ELETROAFINIDADE - tendência de atrair, receber elétrons. Quanto menor o raio atômico mais a eletronegatividade. O flúor é o elemento mais eletronegativo.
*ENERGIA OU POTENCIAL DE IONIZAÇÃO ? energia necessária para remover um elétron de uma substancia no estado gasoso. A cada elétron removido, a energia de ionização aumenta.

loading...
- Química: Representação Dos átomos, Isótopos, Isótonos E Isóbaros
Geralmente, os elementos químicos e seus respectivos átomos são representados por uma ou duas letras derivadas do seu nome em latim ou grego. O número atômico (número de prótons que o átomo daquele elemento tem) deve ser escrito à esquerda da...
- Ligação Covalente
LIGAÇÃO COVALENTEA ligação covalente, geralmente é feita entre os não-metais e não metais, hidrogênio e não-metais e hidrogênio com hidrogênio. Esta ligação é caracterizada pelo compartilhamento de elétrons. O hidrogênio possui um elétron...
- A Estrutura Do átomo
A estrutura do átomo O átomo tem como composição os elétrons, prótons e nêutrons. Os prótons tem carga positiva, os elétrons têm carga negativa e os nêutrons como o próprio nome diz não tem carga. Referente ao peso o elétron tem peso quase...
- Modelo Atômico
Modelo atômico O conceito de átomo começou antes de cristo quando Demócrito disse que toda matéria era construída por partículas minúsculas, individuais denominadas átomos. Os principais modelos: O modelo de John Dalton ? bola de bilhar-1808:...
- Quimica
Cátions e ânions são íons (átomos ou moléculas que perderam ou ganharam elétrons). Cátions têm carga positiva e ânions carga negativa. Por que isso? Simples: Alguns átomos, para se tornarem estáveis, liberam ou ganham elétrons, até que sua...
