Casa dos Resumos
1. Características
- conduzem eletricidade quando estão na fase líquida (fundidos) ou em solução aquosa, porque nestes casos há elétrons livres;
- geralmente são sólidos à temperatura e pressão ambiente (25°C e 1atm).
2. Neutralização
A neutralização faz com que os íons H+ e OH? presentes em solução se transformem em água e, dessa forma, apenas os outros íons provenientes do ácido e da base permaneçam em solução. ácido + base ? sal + água Exemplo:
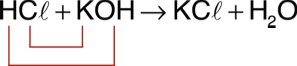
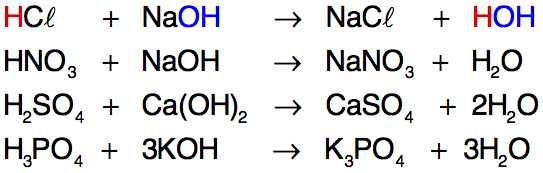
Neutralização parcial Quando a quantidade de íons H+ fornecidos pelo ácido for igual à de íons OH? fornecidos pela base, acontecerá neutralização total. A neutralização parcial ocorre quando há um excesso de H+ (neutralização parcial do ácido) ou de OH? (neutralização parcial da base). Assim, resta na fórmula do sal H+ ou OH? sem sofrer reação. Exemplos: 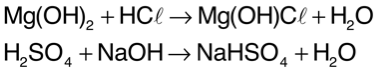
3. Nomenclatura
Os sais derivam da reação de um ácido ou óxido com uma base.
Os sais sem oxigênio mudam a terminação IDRICO para a terminação ETO. Exemplo:
Hidrogenos?sais: nomenclatura
Hidroxi?sais: nomenclatura
- Anatomia Comparada: Excreção
? Denomina-se excretas apenas resíduos do metabolismo celular (substância que passam pelo interior das células). ? Funções do sistema excretor: controla a concentração de líquidos no corpo (osmorregulação); elimina substâncias prejudiciais;...
- Óxidos
Óxidos Esses elementos são caracterizados por se tratarem de compostos binários, ou seja, formados por dois elementos ? como é o caso do seguinte exemplo: FeO + Fe2O3 = Fe3O4 ? sendo um dos quais o oxigênio, e algum outro que esteja presente...
- Bases
BasesAs bases podem ser encontradas em vários líquidos de limpeza usados nas cozinhas, como o hidróxido de sódio (NaOH), presente em substâncias para desentupir pias. Arrhenius definiu as bases como sendo compostos, que dissociados em água, libera...
- Ácidos
Muita atenção nesse assunto, qualquer erro faz você errar tudo e são MUITOS detalhes. Ácidos: -Hidrácidos: são ácidos que não possuem oxigênio em sua molécula. A nomenclatura desse tipo de ácido é simples e fácil. ácido...
- Química Ii
*Modelo de Bohr -Salto Quântico (teste da chama) NaCl ? chama laranja KCl ? chama violeta Cu So4 - chama verde Ca Cl2 ? chama vermelha *ALOTROPIA: Propriedade que certos elementos tem, pois constituem substâncias simples diferentes. *Fenômeno Físico:...
Casa dos Resumos
Sais
Sais
O sal comum, NaCl está presente em nossa alimentação, na conservação de alimentos, o bicardonato de sódio, NaHCO3, é usado comop antiácido e também no preparo de bolos e biscoitos. Sal é toda substância que em água produz um cátion diferente do H+ e um ânion diferente do OH-.
Os sais são formados a partir da reação de um ácido com uma base, que é a reação de neutralização, formando também água.
HCl + NaOH ? NaCl + H2O Os sais são formados a partir da reação de um ácido com uma base, que é a reação de neutralização, formando também água.
1. Características
- conduzem eletricidade quando estão na fase líquida (fundidos) ou em solução aquosa, porque nestes casos há elétrons livres;
- geralmente são sólidos à temperatura e pressão ambiente (25°C e 1atm).
2. Neutralização
A neutralização faz com que os íons H+ e OH? presentes em solução se transformem em água e, dessa forma, apenas os outros íons provenientes do ácido e da base permaneçam em solução. ácido + base ? sal + água Exemplo:
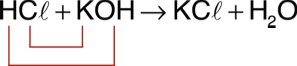

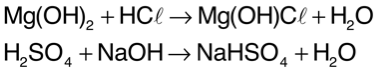
3. Nomenclatura
Os sais derivam da reação de um ácido ou óxido com uma base.
Os sais sem oxigênio mudam a terminação IDRICO para a terminação ETO. Exemplo:
- CaS ? sulfeto de cálcio, vem do ácido sulfídrico
- RbH ? fluoreto de rubídio, vem do ácido fluorídrico
- Na2SO3 ? sulfito de sódio, vem do ácido sulfuroso
- LiNO2 ? nitrito de lítio, vem do ácido nitroso
- Na2SO4 ? sulfato de sódio, vem do ácido sulfúrico
- NaClO3 ? clorato de sódio, vem do ácido clórico.
- NaPO3 ? metafosfato de sódio, vem do ácido metafosfórico
- Ca2P2O7 ? pirofosfato de cálcio, vem do ácido pirofosfórico.
A única diferença dos sais normais é que indicaremos a quantidade de hidrogênios ionizáveis por meio dos prefixos mono-hidrogeno (o mono pode ser omitido), di-hidrogeno etc.
NaH2PO4 ? di-hidrogeno-fosfato de sódio
Na2HPO4 ? (mono-)hidrogeno-fosfato de sódio
NaHSO4 ? (mono-)hidrogeno-sulfato de sódio
NaHCO3 ? (mono-)hidrogeno-carbonato de sódio
NaH2PO4 ? di-hidrogeno-fosfato de sódio
Na2HPO4 ? (mono-)hidrogeno-fosfato de sódio
NaHSO4 ? (mono-)hidrogeno-sulfato de sódio
NaHCO3 ? (mono-)hidrogeno-carbonato de sódio
Os hidrogenos-sais eram antigamente chamados de sais ácidos. Assim, outra opção para dar nome a esses sais é utilizar-se dos termos monoácido, diácido etc.
NaH2PO4 ? fosfato diácido de sódio
NaHSO4 ? sulfato (mono)ácido de sódio
NaHSO4 ? sulfato (mono)ácido de sódio
Quando o hidrogeno-sal for originário de um ácido com dois hidrogênios ionizáveis (e somente nesses casos), pode-se substituir o prefixo mono-hidrogeno por bi. Nesse contexto, o prefixo Bi não tem o significado de ?dois?.
NaHSO4 ? bisulfato de sódio
NaHCO3 ? bicarbonato de sódio
NaHSO4 ? bisulfato de sódio
NaHCO3 ? bicarbonato de sódio
Nomenclatura semelhante a dos hidrogenia-sais.
Al(OH)2Cl ? di-hidroxi-cloreto de alumínio
Al(OH)Cl2 ? (mono-)hidróxi-cloreto de alumínio
Ca(OH)NO3 ? (mono-)hidroxi-nitrato de cálcio
Al(OH)2Cl ? di-hidroxi-cloreto de alumínio
Al(OH)Cl2 ? (mono-)hidróxi-cloreto de alumínio
Ca(OH)NO3 ? (mono-)hidroxi-nitrato de cálcio
Ou ainda, de acordo com uma nomenclatura antiga
Al(OH)2Cl ? cloreto dibásico de alumínio
Al(OH)Cl2 ? cloreto (mono)básico de alumínio
Ca(OH)NO3 ? nitrato (mono)básico de cálcio
Al(OH)Cl2 ? cloreto (mono)básico de alumínio
Ca(OH)NO3 ? nitrato (mono)básico de cálcio
loading...
- Anatomia Comparada: Excreção
? Denomina-se excretas apenas resíduos do metabolismo celular (substância que passam pelo interior das células). ? Funções do sistema excretor: controla a concentração de líquidos no corpo (osmorregulação); elimina substâncias prejudiciais;...
- Óxidos
Óxidos Esses elementos são caracterizados por se tratarem de compostos binários, ou seja, formados por dois elementos ? como é o caso do seguinte exemplo: FeO + Fe2O3 = Fe3O4 ? sendo um dos quais o oxigênio, e algum outro que esteja presente...
- Bases
BasesAs bases podem ser encontradas em vários líquidos de limpeza usados nas cozinhas, como o hidróxido de sódio (NaOH), presente em substâncias para desentupir pias. Arrhenius definiu as bases como sendo compostos, que dissociados em água, libera...
- Ácidos
Muita atenção nesse assunto, qualquer erro faz você errar tudo e são MUITOS detalhes. Ácidos: -Hidrácidos: são ácidos que não possuem oxigênio em sua molécula. A nomenclatura desse tipo de ácido é simples e fácil. ácido...
- Química Ii
*Modelo de Bohr -Salto Quântico (teste da chama) NaCl ? chama laranja KCl ? chama violeta Cu So4 - chama verde Ca Cl2 ? chama vermelha *ALOTROPIA: Propriedade que certos elementos tem, pois constituem substâncias simples diferentes. *Fenômeno Físico:...
