Casa dos Resumos
Valência
Na química, valência é um número que indica a capacidade que um átomo de um elemento tem de se combinar com outros átomos, capacidade essa que é medida pelo número de elétrons que um átomo pode dar, receber, ou compartilhar de forma a constituir uma ligação química.
Fórmula de Lewis o u Fórmula Eletrônica
u Fórmula Eletrônica

Fórmula de Lewis
Fórmula Estrutural
- Química: Representação Dos átomos, Isótopos, Isótonos E Isóbaros
Geralmente, os elementos químicos e seus respectivos átomos são representados por uma ou duas letras derivadas do seu nome em latim ou grego. O número atômico (número de prótons que o átomo daquele elemento tem) deve ser escrito à esquerda da...
- A Estrutura Do átomo
A estrutura do átomo O átomo tem como composição os elétrons, prótons e nêutrons. Os prótons tem carga positiva, os elétrons têm carga negativa e os nêutrons como o próprio nome diz não tem carga. Referente ao peso o elétron tem peso quase...
- Modelo Atômico
Modelo atômico O conceito de átomo começou antes de cristo quando Demócrito disse que toda matéria era construída por partículas minúsculas, individuais denominadas átomos. Os principais modelos: O modelo de John Dalton ? bola de bilhar-1808:...
- Quimica
Cátions e ânions são íons (átomos ou moléculas que perderam ou ganharam elétrons). Cátions têm carga positiva e ânions carga negativa. Por que isso? Simples: Alguns átomos, para se tornarem estáveis, liberam ou ganham elétrons, até que sua...
- Química I
DISTRIBUIÇÃO ELETRÔNICA LIGAÇÕES QUIMICAS *Os elementos querem imitar os gases nobres, ou seja, ter 8 elétrons na última camada (estabilidade) * os outros elementos para adquirir estabilidade doam ou compartilham elétrons, fazendo ligações...
Casa dos Resumos
Última postagem - Valência e Ligações químicas
Valência
Na química, valência é um número que indica a capacidade que um átomo de um elemento tem de se combinar com outros átomos, capacidade essa que é medida pelo número de elétrons que um átomo pode dar, receber, ou compartilhar de forma a constituir uma ligação química.
LIGAÇÕES QUÍMICAS
Os átomos dificilmente ficam sozinhos na natureza. Eles tendem a se unir uns aos outros, formando assim tudo o que existe hoje.
Alguns átomos são estáveis, ou seja, pouco reativos. Já outros não podem ficar isolados. Precisam se ligar a outros elementos. As forças que mantêm os átomos unidos são fundamentalmente de natureza elétrica e são chamadas de Ligações Químicas.
Toda ligação envolve o movimento de elétrons nas camadas mais externas dos átomos, mas nunca atinge o núcleo.
ESTABILIDADE DOS GASES NOBRES
De todos os elementos químicos conhecidos, apenas 6, os gases nobres ou raros, são encontrados na natureza na forma de átomos isolados. Os demais se encontram sempre ligados uns aos outros, de diversas maneiras, nas mais diversas combinações.
Os gases nobres são encontrados na natureza na forma de átomos isolados porque eles têm a última camada da eletrosfera completa, ou seja, com 8 elétrons. Mesmo o hélio, com 2 elétrons, está completo porque o nível K só permite, no máximo, 2 elétrons.
Regra do Octeto ? Os elementos químicos devem sempre conter 8 elétrons na última camada eletrônica ou camada de valência. Na camada K pode haver no máximo 2 elétrons. Desta forma os átomos ficam estáveis, com a configuração idêntica à dos gases nobres.
Observe a distribuição eletrônica dos gases nobres na tabela a seguir:
NOME | SÍMBOLO | Z | K | L | M | N | O | P | Q |
HÉLIO | He | 2 | 2 | - | - | - | - | - | - |
NEÔNIO | Ne | 10 | 2 | 8 | - | - | - | - | - |
ARGÔNIO | Ar | 18 | 2 | 8 | 8 | - | - | - | - |
CRIPTÔNIO | Kr | 36 | 2 | 8 | 18 | 8 | - | - | - |
XENÔNIO | Xe | 54 | 2 | 8 | 18 | 18 | 8 | - | - |
RADÔNIO | Rn | 86 | 2 | 8 | 18 | 32 | 18 | 8 | - |
A estabilidade dos gases nobres deve-se ao fato de que possuem a última camada completa, ou seja, com o número máximo de elétrons que essa camada pode conter, enquanto última. Os átomos dos demais elementos químicos, para ficarem estáveis, devem adquirir, através das ligações químicas, eletrosferas iguais às dos gases nobres.
Há três tipos de ligações químicas:
- Ligação Iônica ? perda ou ganho de elétrons.
- Ligação Covalente ? compartilhamento de elétrons.
- Ligação Metálica ? átomos neutros e cátions mergulhados numa "nuvem" de elétrons.
- Ligação Covalente ? compartilhamento de elétrons.
- Ligação Metálica ? átomos neutros e cátions mergulhados numa "nuvem" de elétrons.
LIGAÇÃO IÔNICA
A ligação iônica é resultado da alteração entre íons de cargas elétricas contrárias (ânions e cátions).
Esta ligação acontece, geralmente, entre os metais e não-metais.
Esta ligação acontece, geralmente, entre os metais e não-metais.
Metais ? 1 a 3 elétrons na última camada; tendência a perder elétrons e formar cátions. Elementos mais eletropositivos ou menos eletronegativos.
Não-Metais ? 5 a 7 elétrons na última camada; tendência a ganhar elétrons e formar ânions. Elementos mais eletronegativos ou menos eletropositivos.
Não-Metais ? 5 a 7 elétrons na última camada; tendência a ganhar elétrons e formar ânions. Elementos mais eletronegativos ou menos eletropositivos.
Então:
METAL + NÃO-METAL ? LIGAÇÃO IÔNICA
Exemplo: Na e Cl
Na (Z = 11) K = 2 L = 8 M = 1
Cl (Z = 17) K = 2 L = 8 M = 7
Na (Z = 11) K = 2 L = 8 M = 1
Cl (Z = 17) K = 2 L = 8 M = 7
O Na quer doar 1 é ? Na+ (cátion)
O Cl quer receber 1 é ? Cl ? (ânion)
O Cl quer receber 1 é ? Cl ? (ânion)
O cloro quer receber 7é na última camada. Para ficar com 8é (igual aos gases nobres) precisa de 1é.
Na+ Cl ? ? NaCl
cátion ânion cloreto de sódio
As ligações iônicas formam compostos iônicos que são constituídos de cátions e ânions. Tais compostos iônicos formam-se de acordo com a capacidade de cada átomo de ganhar ou perder elétrons. Essa capacidade é a valência.
cátion ânion cloreto de sódio
As ligações iônicas formam compostos iônicos que são constituídos de cátions e ânions. Tais compostos iônicos formam-se de acordo com a capacidade de cada átomo de ganhar ou perder elétrons. Essa capacidade é a valência.
Exemplo: Mg e Cl
Mg+2 Cl 1- ? MgCl2
cátion ânion cloreto de magnésio
cátion ânion cloreto de magnésio
Pode-se utilizar a ?Regra da Tesoura?, onde o cátion passará a ser o número de cloros (não-metal) na fórmula final e o ânion será o número de magnésio (metal).
Outro exemplo: Al e O
Al +3 O -2 ? Al2O3
cátion ânion óxido de alumínio
cátion ânion óxido de alumínio
Neste caso, também foi utilizada a ?Regra da Tesoura?.
A fórmula final será chamada de íon fórmula.
A fórmula final será chamada de íon fórmula.
LIGAÇÃO COVALENTE
A ligação covalente, geralmente é feita entre os não-metais e não metais, hidrogênio e não-metais e hidrogênio com hidrogênio.
Esta ligação é caracterizada pelo compartilhamento de elétrons. O hidrogênio possui um elétron na sua camada de valência. Para ficar idêntico ao gás nobre hélio com 2 elétrons na última camada. Ele precisa de mais um elétron. Então, 2 átomos de hidrogênio compartilham seus elétrons ficando estáveis:
Esta ligação é caracterizada pelo compartilhamento de elétrons. O hidrogênio possui um elétron na sua camada de valência. Para ficar idêntico ao gás nobre hélio com 2 elétrons na última camada. Ele precisa de mais um elétron. Então, 2 átomos de hidrogênio compartilham seus elétrons ficando estáveis:
Ex. H (Z = 1) K = 1
H ? H ? H2
O traço representa o par de elétrons compartilhados.
Nessa situação, tudo se passa como se cada átomo tivesse 2 elétrons em sua eletrosfera. Os elétrons pertencem ao mesmo tempo, aos dois átomos, ou seja, os dois átomos compartilham os 2 elétrons. A menor porção de uma substância resultante de ligação covalente é chamada de molécula. Então o H2 é uma molécula ou um composto molecular. Um composto é considerado composto molecular ou molécula quando possui apenas ligações covalentes
Observe a ligação covalente entre dois átomos de cloro:
Fórmula de Lewis o
 u Fórmula Eletrônica
u Fórmula EletrônicaCl ? Cl
Fórmula Estrutural
Fórmula Estrutural
Cl 2
Fórmula Molecular
Fórmula Molecular
Conforme o número de elétrons que os átomos compartilham, eles podem ser mono, bi, tri ou tetravalentes.
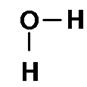
A ligação covalente pode ocorrer também, entre átomos de diferentes elementos, por exemplo, a água.

Fórmula de Lewis

Fórmula Estrutural
H2O
Fórmula Molecular
Fórmula Molecular
A água, no exemplo, faz três ligações covalentes, formando a molécula H2O. O oxigênio tem 6é na última camada e precisa de 2é para ficar estável. O hidrogênio tem 1 é e precisa de mais 1é para se estabilizar. Sobram ainda dois pares de elétrons sobre o átomo de oxigênio.
A ligação covalente pode ser representada de várias formas.
As fórmulas em que aparecem indicados pelos sinais . ou x são chamadas de fórmula de Lewis ou fórmula eletrônica.
Quando os pares de elétrons são representados por traços (-) chamamos de fórmula estrutural plana, mostrando o número de ligações e quais os átomos estão ligados.
A fórmula molecular é a mais simplificada, mostrando apenas quais e quantos átomos têm na molécula.
A ligação covalente pode ser representada de várias formas.
As fórmulas em que aparecem indicados pelos sinais . ou x são chamadas de fórmula de Lewis ou fórmula eletrônica.
Quando os pares de elétrons são representados por traços (-) chamamos de fórmula estrutural plana, mostrando o número de ligações e quais os átomos estão ligados.
A fórmula molecular é a mais simplificada, mostrando apenas quais e quantos átomos têm na molécula.
loading...
- Química: Representação Dos átomos, Isótopos, Isótonos E Isóbaros
Geralmente, os elementos químicos e seus respectivos átomos são representados por uma ou duas letras derivadas do seu nome em latim ou grego. O número atômico (número de prótons que o átomo daquele elemento tem) deve ser escrito à esquerda da...
- A Estrutura Do átomo
A estrutura do átomo O átomo tem como composição os elétrons, prótons e nêutrons. Os prótons tem carga positiva, os elétrons têm carga negativa e os nêutrons como o próprio nome diz não tem carga. Referente ao peso o elétron tem peso quase...
- Modelo Atômico
Modelo atômico O conceito de átomo começou antes de cristo quando Demócrito disse que toda matéria era construída por partículas minúsculas, individuais denominadas átomos. Os principais modelos: O modelo de John Dalton ? bola de bilhar-1808:...
- Quimica
Cátions e ânions são íons (átomos ou moléculas que perderam ou ganharam elétrons). Cátions têm carga positiva e ânions carga negativa. Por que isso? Simples: Alguns átomos, para se tornarem estáveis, liberam ou ganham elétrons, até que sua...
- Química I
DISTRIBUIÇÃO ELETRÔNICA LIGAÇÕES QUIMICAS *Os elementos querem imitar os gases nobres, ou seja, ter 8 elétrons na última camada (estabilidade) * os outros elementos para adquirir estabilidade doam ou compartilham elétrons, fazendo ligações...
